- Khái niệm Anken
- Cấu tạo Anken
- Đặc điểm cấu tạo
- Đồng đẳng Anken
- Đồng phân Anken
- Danh pháp của Anken
- Tính chất mặt vật lý
- Tính chất mặt hóa học
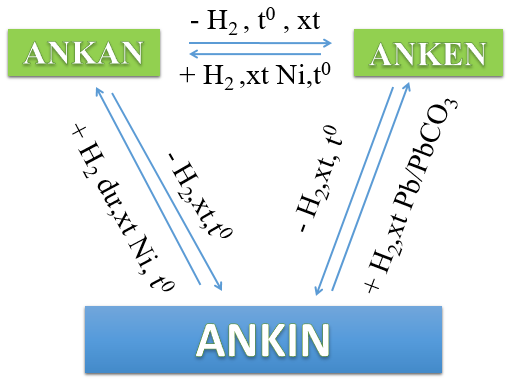
- Dạng phản ứng cộng Hidro
- Dạng phản ứng cộng hợp Halogen
- Dạng phản ứng cộng hợp Hiđro halogenua
- Dạng phản ứng Anken cộng hợp H2O
- Dạng phản ứng trùng hợp của Anken
- Dạng phản ứng oxi hoá của Anken
- Cách điều chế và ứng dụng Anken
- Cách thức điều chế
- Ứng dụng Anken
- Bài tập về phản ứng cộng Anken
- Phương pháp giải
- BT minh họa
- Bài tập về phản ứng oxi hóa Anken
- Phương pháp giải
- BT minh họa
- Bài tập về phản ứng Anken
- Phương pháp giải
- BT minh họa
- Các câu hỏi trắc nghiệm
Hóa học là một bộ môn quan trọng trong chương trình Giáo dục Phổ thông. Đặc biệt là với các bạn học sinh thuộc ban A Toán – Lý – Hóa. Qua bài viết hôm nay, hãy cùng tìm hiểu xem Anken là gì? Ứng dụng và cách giải các bài tập liên quan về Anken nhé.
Khái niệm Anken
Cùng nhau lướt qua phần đầu tiên khá quan trọng, chính là lý thuyết tổng hợp về Anken trong bài hôm nay.
Trong hóa hữu cơ Anken được định nghĩa là 1 hợp chất chỉ chứa cacbon và hidro (hidrocacbon không no). Anken chỉ chứa 1 liên kết đôi C=C trong cấu tạo. Phần còn lại của nó là các liên kết đơn tạo thành một dãy đồng đẳng.
Anken có công thức tổng quát như sau: CnH2n (n ≥ 2).
Cấu tạo Anken
Hợp chất Anken có cấu tạo như thế nào? Có đồng đẳng, đồng phân và danh pháp hay không? Cùng nhau khám phá từng mục thú vị này nhé.
Đặc điểm cấu tạo
Anken có tính chất cấu tạo như sau:
- Có thể phân nhánh hoặc không phân nhánh trong mạch C hở.
- Có 1 liên kết đôi: gồm 1 liên kết d và 1 liên kết p trong 1 phân tử.
- Tham gia 3 liên kết d nhờ 3 obitan lai hoá sp2, còn liên kết p nhờ obitan p không lai hoá ở thể liên kết đôi.
- Khoảng cách giữa 2 nguyên tử C = C ngắn lại và hai nguyên tử C này không thể quay quanh liên kết đôi do liên kết p. Lý do chúng không quay là vì khi quay như vậy liên kết p bị phá vỡ.
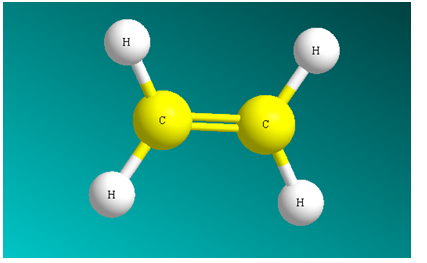
Đồng đẳng Anken
Dãy đồng đẳng có công thức phân tử chung CnH2n (n > 2) và được gọi là Anken hay Olefin. Nó được cấu tạo từ Etilen (CH2 = CH2) và các chất tiếp theo có công thức phân tử C3H6 C4H8, C5H10,… với tính chất tương tự Etilen.
Đồng phân Anken
Về cấu tạo: không có đồng phân Anken đối với Etilen và Propilen. Mà ứng với một công thức phân tử từ C4H8 trở đi sẽ có các đồng phân Anken về vị trí liên kết đôi và về mạch cacbon.
Về hình học:
Mạch cacbon dài nhất là mạch có chứa liên kết đôi C=C trong phân tử anken. Sẽ có sự phân bố không gian khác nhau của mạch chính xung quanh liên kết đôi liên kết với hai nhóm nguyên tử khác nhau.
Đồng phân hình học được tạo ra từ sự phân bố khác nhau đó. Có 2 loại đồng phân hình học là:
- Cis: là đồng phân có mạch chính ở cùng một phía của liên kết đôi.
- Trans: có mạch chính ở về hai phía khác nhau của liên kết đôi.

Danh pháp của Anken
Tên gọi phổ biến: chỉ một số ít Anken là có tên gọi riêng. Việc đặt tên chủ yếu xuất phát từ tên ankan có cùng số nguyên tử cacbon. Gọi tên chúng bằng cách đổi đuôi -an thành -ilen.
VD: propylene C3H6; butilen C4H8, ethylene C2H4.
Tên gọi thay thế:
Trong tên anken cần thêm số chỉ vị trí nguyên tử cacbon đầu tiên chứa liên kết đôi từ C4H8 trở đi. Cách thay thế này xuất phát từ tên ankan tương ứng bằng cách đổi đuôi -an thành -en.
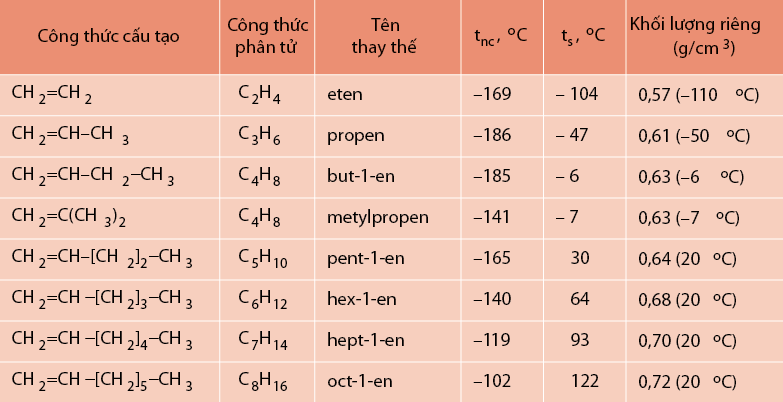
Tính chất mặt vật lý
Anken có thông số về nhiệt độ sôi, nhiệt độ nóng chảy và khối lượng riêng hông khác nhiều với ankan tương ứng. Các Anken thường có đặc điểm là nhỏ hơn xicloankan có cùng số nguyên tử C.
Ngoài ra, Anken có các tính chất vật lý cần kể đến như:
- Đều nhẹ hơn nước.
- Nhiệt độ nóng chảy và nhiệt độ sôi tăng theo khối lượng mol phân tử.
- Là những hidrocacbon không có màu cũng không có mùi. Và chúng không tan trong nước.
- Ở thể khí: số nguyên tử C từ 2 đến 4.
- Ở thể lỏng: số nguyên tử C từ 5 đến 17.
- Ở thể rắn: số nguyên tử C từ 18 trở lên.
- Có t0 sôi và nóng chảy thấp.
- Khả năng hòa tan được trong một số dung môi hữu cơ.

Tính chất mặt hóa học
Liên kết đôi π trong phân tử anken kém bền hơn so với liên kết đơn σ. Nên phân tử này mang tính chất hóa học tiêu biểu là tham gia phản ứng cộng, trùng hợp và oxi hóa. Tính chất hóa học của Anken như sau:
Dạng phản ứng cộng Hidro
Dạng PT: Anken + H2 → Ankan
CH2=CH2 + H2 → CH3-CH3
PT tổng quát: CnH2n + H2 → CnH2n+2
Dạng phản ứng cộng hợp Halogen
Khi Etilen phản ứng với Clo: CH2=CH2 + Cl2 → CH2Cl-CH2Cl (1,2-đicloetan)
Khi Etilen làm mất màu DD Brom: CH2=CH2 + Br2 → CH2Br-CH2Br (1,2-đibrometan)
PT tổng quát: CnH2n + Br2 → CnH2nBr2
NX: dùng Brom để nhận biết được etilen và anken nói chung. Mức độ tăng dần phản ứng từ I2 → Br2 → Cl2.
Dạng phản ứng cộng hợp Hiđro halogenua
Khi Anken + HCl: CH2=CH2 + HCl → CH3-CH2Cl
Lưu ý: hỗn hợp sản phẩm có sản phẩm chính và sản phẩm phụ do đồng đẳng của Anken phản ứng tạo ra. Clo sẽ được thế vào những vị trí khác nhau trên mạch cacbon.
CH3-CH=CH2 + HCl → CH3-CHCl-CH3 (SPC)
CH3-CH2-CH2-Cl (SPP)
Khi Anken + HBr: CH2=CH2 + HBr → CH3-CH2-Br
Lưu ý:
- Phản ứng dễ dần theo thứ tự: HCl → HBr→ HI.
- Hỗn hợp 2 sản phẩm được tạo ra từ phản ứng cộng HX vào anken bất đối.
- Tuân theo quy tắc Maccopnhicop khi cộng HX đối với các anken khác bất đối xứng.
- Đảo ngược quy tắc Maccopnhicop khi thực hiện phản ứng cộng HBr vào anken có xúc tác peoxit.

*** Về quy tắc cộng Maccopnhicop: nguyên tử H ưu tiên cộng vào nguyên tử Cacbon bậc thấp hơn trong phản ứng cộng HX vào liên kết bội. Còn về nguyên tử hay 1 nhóm nguyên tử X được ưu tiên cộng vào nguyên tử Cacbon bậc cao hơn.
Dạng phản ứng Anken cộng hợp H2O
Cộng hợp nước của Etilen: CH2=CH2 + H2O CH3-CH2-OH
Đồng đẳng của Etilen: CH3-CH=CH2 + H2O → CH3-CHOH-CH3 (SPC)
CH3-CH2– CH2-OH (SPP)
Lưu ý: khi cộng H2O với các anken khác bất đối xứng cũng tuân theo quy tắc Maccopnhicop (nhóm – OH đính vào C bậc cao).
Dạng phản ứng trùng hợp của Anken
Trường hợp có xúc tác, đun nóng, áp suất cao:
Ta có: nCH2=CH2 → (-CH2–CH2-)n (Polietylen hay PE)
Ta có: nCH2=CH–CH3 → (-CH2–CH(CH3)-)n (Polipropilen hay PP)
Sơ đồ PƯTH: nA (B)n

Dạng phản ứng oxi hoá của Anken
Phản ứng không hoàn toàn: tạo thành ancol đa chức có 2 nhóm -OH hoặc đứt mạch C chỗ nối đôi tạo thành andehit hoặc axit.
Mất màu dung dịch thuốc tím: Anken + KMnO4
3C2H4 + 2KMnO4 + 4H2O → 3C2H4(OH)2 + 2KOH + 2MnO2
PT tổng quát: 3CnH2n + 2KMnO4 + 4H2O → 3CnH2n(OH)2 + 2KOH + 2MnO2
NX: có thể dùng dung dịch thuốc tím để nhận biết anken. Nhưng riêng CH2=CH2 còn có phản ứng oxi hóa không hoàn toàn tạo CH3CHO ( CH2=CH2 + 1/2O2 CH3CHO)
Phản ứng cháy (Anken + O2)
PT tổng quát: CnH2n + 3n/2O2 → nCO2 + nH2O
Lưu ý: Đặc điểm phản ứng: nCO2 = nH2O.
Cách điều chế và ứng dụng Anken
Anken có khá nhiều cách điều chế khác nhau cùn như sự ứng dụng vào đa lĩnh vực. Hãy lướt qua phần sau bài viết để hiểu rõ hơn nhé.
Cách thức điều chế
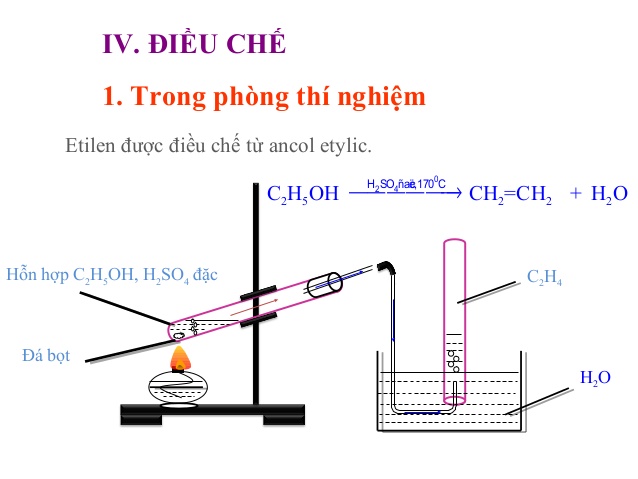
Trong các phòng thí nghiệm thì người ta điều chế Anken bằng cách tách nước từ Ancol Etylic
Sơ đồ tổng quát: CnH2n+1OH –H2SO4 đặc, ≥ 170ºC→ CnH2n + H2O
VD: C2H5OH –H2SO4 đặc, ≥ 170ºC→ C2H4 + H2O
Trong công nghiệp thì Anken được sản xuất từ nguồn khí chế biến dầu mỏ. Có nhiều cách tách chúng khỏi dầu mỏ như sau:
- Tiến hành tiến hành tách H2 khỏi ankan: CnH2n+2 → CnH2n + H2 (Fe, t0)
- Tiến hành tách HX từ dẫn xuất: CnH2n+1X + NaOH → CnH2n + NaX + H2O (ancol)
- Tiến hành tách X2 từ dẫn xuất đihalogen: CnH2nX2 + Zn → CnH2n + ZnBr2 (t0)
- Tiến hành cộng H2 có xúc tác Pd/PbCO3 vào ankin hoặc ankađien: CnH2n-2 + H2 → CnH2n
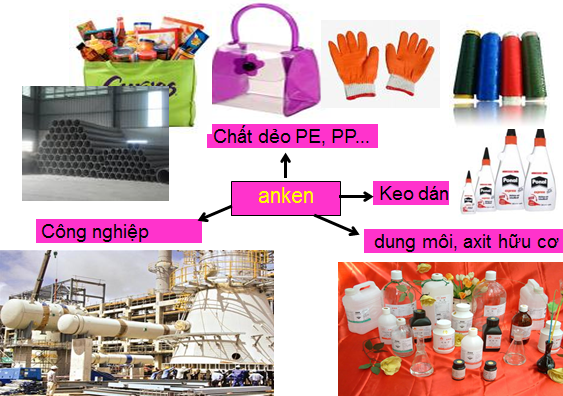
Ứng dụng Anken
Hỗn hợp Anken thường được ứng dụng vào nhiều mặt trong đời sống, cụ thể có thể kể đến như:
- Sản xuất rượu, các dẫn xuất halogen, rượu và các chất khác.
- Dùng cho phản ứng trùng hợp polime: polipropilen, polietilen.
- Làm chín quả.
Bài tập về phản ứng cộng Anken
Để các bạn dễ hình dung về bài tập liên quan đến Anken, xin gửi đến bạn các mẫu bài chủ chốt trong bài viết.
Phương pháp giải
Cộng HX, X2 ta cần xác định tỉ lệ mol giữa HX, X2 với CxHy để từ đó → CTTQ của hợp chất hữu cơ
Cộng H2: Số mol khí giảm sau phản ứng bằng số mol của H2 đã phản ứng: nkhí⏐↓ = nH2(pu)nkhí↓ = nH2(pu)
Lưu ý: Sẽ có H2 dư sau khi cộng H2 mà khối lượng mol trung bình của sản phẩm tạo thành nhỏ hơn 28 thì
BT minh họa
VD1: 2,8 gam anken X làm mất màu vừa đủ dung dịch chứa 8 gam Br2. Đem đi Hiđrat hóa X thì chỉ thu được một ancol duy nhất. X có tên là gì?
Đáp án: nBr2 =8160=0,05 mol → nanken =nBr2 =0,05 mol→ Manken = 2,8 0,05=56→ anken có CTPT là C4H8nBr2 =8160=0,05 mol → nanken =nBr2 =0,05 mol→ Manken = 2,8 0,05=56→ anken có CTPT là C4H8
Vì hiđrat hóa A chỉ thu được 1 ancol duy nhất →→ A là CH3-CH=CH-CH3 (but-2-en)
VD 2: Dẫn 3,36 lít hỗn hợp X gồm 2 anken là đồng đẳng kế tiếp vào bình nước brom dư, thấy khối lượng bình tăng thêm 7,7 gam. Tìm CTPT của 2 anken ?
Đáp án:
nX = 3,3622,4 = 0,15 molnX = 3,3622,4 = 0,15 mol
CnH2n + Br2 → CnH2nBr2
Khối lượng bình brom tăng bằng khối lượng của 2 anken: →mX = 7,7 gam→mX = 7,7 gam
MCnH2n=7,70,15≈51,3 →n=3,67MCnH2n=7,70,15≈51,3 →n=3,67
Vậy đáp án CTPT của 2 anken kế tiếp là: C3H6 và C4H8
Bài tập về phản ứng oxi hóa Anken
Phương pháp giải
Oxi hóa hoàn toàn:
- Trường hợp đốt cháy anken thu được:
nCO2=nH2OnCO2=nH2
- Trường hợp đốt cháy hỗn hợp ankan và anken thì nankan=nH2O−nCO2nankan=nH2O−nCO2
- Trường hợp đốt cháy hỗn hợp anken và ankin thì nankin=nCO2−nH2Onankin=nCO2−nH2O
Dùng phương pháp trung bình để giải trường hợp đề bài cho hỗn hợp anken
Oxi hóa không hoàn toàn:
3CnH2n+2KMnO4+4H2O→3CnH2n(OH)2 +2KOH + 2MnO23
CnH2n+2KMnO4+4H2O→3CnH2nOH2 +2KOH + 2MnO2
Lưu ý: Để phân biệt anken và ankan dùng đến phản ứng làm mất màu tím của dung dịch KMnO4 và tạo kết tủa đen MnO2. KL dung dịch KMnO4 biến thiên = |khối lượng anken – khối lượng kết tủa|
PP: Áp dụng định luật bảo toàn khối lượng hoặc tính theo phương trình.
BT minh họa
VD1: Đốt cháy hoàn toàn 0,05 mol một anken A thu được 4,48 lít CO2 (đktc). Rồi cho anken đó đem tác dụng với dd HBr chỉ cho 1 sản phẩm duy nhất. CTCT của A là
Đáp án: CO2 =4,4822,4=0,2 →nCO2 =4 nA → A có 4 CnCO2 =4,4822,4=0,2 →nCO2 =4 nA → A có 4 C
⇒ A là C4H8
A tác dụng với dd HBr chỉ cho một sản phẩm duy nhất
⇒ CTCT của A là CH3CH=CHCH3
VD 2: Người ta cho đốt cháy hoàn toàn 0,2 mol hỗn hợp X gồm một ankan và một anken, thu được 0,35 mol CO2 và 0,4 mol H2O. Hỏi thành phần %số mol của anken có trong X là?
Đáp án: CnH2n + 3n2O2 → nCO2 + nH2OCnH2n+2 +3n+12O2 → nCO2 + (n+1)H2Onankan = nH2O − nCO2=0,4–0,35=0,05 (mol)nanken =0,2–0,05=0,15 mol → %Vanken =0,152.100% = 75%CnH2n + 3n2O2 → nCO2 + nH2OCnH2n+2 +3n+12O2 → nCO2 + n+1H2Onankan = nH2O − nCO2=0,4–0,35=0,05 molnanken =0,2–0,05=0,15 mol → %Vanken =0,152.100% = 75%
VD 3: Muốn khử hoàn toàn 200 ml dung dịch KMnO4 0,2M tạo thành chất rắn màu đen cần V lít khí C2H4 (đktc). Vậy giá trị tối thiểu của V là?
Đáp án: nKMnO4 =0,2.0,2=0,04(mol)3C2H4 + 2KMnO4 + 4H2O → 3C2H4(OH)2 + 2MnO2 + 2KOH 0,06 ← 0,04 → V=0,06.22,4=1,344 (lít)nKMnO4= 0,2.0,2=0,04 (mol)3C2H4 + 2KMnO4 + 4H2O → 3C2H4OH2 + 2MnO2 + 2KOH 0,06 ← 0,04 → V=0,06.22,4=1,344 lít
Bài tập về phản ứng Anken
Các ankađien cũng có thể tham gia phản ứng cộng H2 (xt: Ni); halogen và hiđro halogenua. Tùy theo tỉ lệ số mol các chất, nhiệt độ, phản ứng cộng halogen và hiđro halogenua có thể xảy ra tại 1 trong 2 liên kết đôi. Hoặc trong hai đầu ngoài của liên kết đôi hay đồng thời vào cả hai liên kết đôi.
Phương pháp giải
Hiđro:CH2 = CH – CH = CH2 + 2H2 (Ni,to)→CH3 – CH2 – CH2 – CH3
Brom
Cộng 1, 2: CH2=CH–CH=CH2 + Br2 (dd) (-80oC)−→ CH2Br =CHBr– CH-CH2
Cộng 1,4: CH2=CH–CH=CH2 + Br2 (dd) (40oC)→CH2Br –CH=CH-CH2Br
Cộng đồng thời vào 2 nối đôi:
CH2=CH–CH=CH2 + 2Br2 (dd) →CH2Br –CHBr-CHBr-CH2Br
Hiđro halogenua:
Cộng 1,2: CH2=CH–CH=CH2 + HBr (dd) (-80oC)→CH2Br =CH– CH-CH3
Cộng 1,4: CH2=CH–CH=CH2 + HBr (dd) (40oC)→40oC CH3 –CH = CH-CH2Br
BT minh họa
VD 1: Có 1 ankađien X vào 200,0 gam dung dịch Br2 nồng độ 16% thấy dung dịch mất màu và đồng thời khối lượng dung dịch tăng 4,0 gam. Hỏi rằng công thức của ankađien X là?
Đáp án:
nBr2=200.16%100%.160=0,2 mol Br2=200.16%100%.160=0,2 mol
Ta đặt X có dạng CnH2n-2 (n ≥ 3)
CnH2n -2 + 2Br2 → CnH2n-2Br4
0,1……………..0,2 mol
Theo bài ra, khối lượng dung dịch tăng chính là khối lượng của ankađien phản ứng.
⇒14n−2=40,1=40⇒n=3⇒14n−2=40,1=40⇒n=3
Vậy X là C3H4.
VD 2: Có 1 ankađien X tác dụng với HBr trong điều kiện thích hợp thì thu được dẫn xuất Y trong đó brom chiếm 53,69% về khối lượng. Hỏi rằng công thức phân tử của X có thể là?
Đáp án:
MY = 80 : 0,5369 = 149
⇒ MX = 149 – 80 – 1 = 68
⇒ X là C5H8.
VD 3: Điều chế poliisopren theo sơ đồ sau: isopentan isopren poliisopren. Tính KL isopentan cần lấy để điều chế được 1 lượng là 68 gam poliisopren. Cung cấp hiệu suất của quá trình đạt 72%.
Đáp án : Xét 1 mắt xích, poliisopren ta có sơ đồ:
C5H12 → C5H8
72 100%→100% 68 gam
x 72%→72%68 gam
⇒x=68.7268.0,72=100g⇒x=68.7268.0,72=100g
VD 4: Biết rằng phân tử khối trung bình của cao su tự nhiên là 104720. Hỏi rằng số mắt xích gần đúng của cao su nói trên là?
Đáp án: Cao su tự nhiên là polime của isopren Công thức là:
[−CH2−C(CH3)=CH−CH2−]n hay (C5H8)n[−CH2−C(CH3)=CH−CH2−]n hay (C5H8)n
M = 68n = 104720 n = 1540
VD 5: Người ta đốt cháy hoàn toàn hỗn hợp X gồm hai ankađien kế tiếp trong 1 dãy đồng đẳng thì cho ra 28,6 gam CO2 và 9,18 gam nước. Hỏi rằng công thức của 2 ankađien là?
Đáp án:
nCO2=28,644=0,65mol;nH2O=9,1818=0,51molnankadien=nCO2−nH2O=0,14mol¯¯¯C=nCO2nankadien=0,650,14=4,6nCO2=28,644=0,65 mol; nH2O=9,1818=0,51 molnankadien=nCO2−nH2O=0,14 molC¯=nCO2nankadien=0,650,14=4,6
Vậy đáp án là C4H6 và C5H8.

VD 6: Người ta đốt cháy hoàn toàn 0,15 mol hỗn hợp X gồm anken và ankađien chốt được CO2 và H2O. biết số mol CO2 nhiều hơn số mol H2O là 0,1 mol. Cho hỏi vậy 0,15 mol hỗn hợp X có thể làm mất màu dung dịch chứa tối đa bao nhiêu mol brom?
Đáp án: nankadien=nCO2−nH2O=0,1molnanken=nhh−nankadien=0,05molnankadien=nCO2−nH2O=0,1 molnanken=nhh−nankadien=0,05 mol
Số mol Br2 tối đa = 2nankadien + nanken = 0,25 mol
Các câu hỏi trắc nghiệm
C1. Tìm ra kết luận nào sau đây là không đúng ?
A. Ankađien là những Hidrocacbon không no mạch hở. Trong phân tử của nó có 2 liên kết đôi C=C.
B. Ankađien thì có khả năng cộng hợp 2 phân tử hiđro.
C. Các hợp chất có khả năng cộng hợp 2 phân tử hiđro thuộc loại ankađien.
D. Các hiđrocacbon không no mạch hở và có phân tử có hai liên kết đôi cách nhau một liên kết đơn được gọi là ankađien liên hợp.
C2. Người ta thí nghiệm cho phản ứng giữa buta-1,3-đien và HBr ở -80oC (tỉ lệ mol 1:1), sản phẩm chính của phản ứng là
A. CH3CHBrCH=CH2.
B. CH3CH=CHCH2Br.
C. CH2BrCH2CH=CH2.
D. CH3CH=CBrCH3.
C3. Một loại Ankađien liên hợp X có CTPT C5H8. Khi cho X đem tác dụng với H2 thì tạo được hidrocacbon Y với công thức phân tử C5H10 có đồng phân hình học. CTCT của X là
A. CH2=CHCH=CHCH3.
B. CH2=C=CHCH2CH3.
C. CH2=C(CH3)CH=CH2.
D. CH2=CHCH2CH=CH2.
C4. Người ta đốt cháy hoàn toàn 3,40 gam ankađien X, thu được 5,60 lít CO2 (đktc). Công thức phân tử của X là
A. C4H6.
B. C4H8.
C. C4H6.
D. C5H8.

C5. Thí nghiệm đốt cháy hoàn toàn 2,24 lít khí X (đktc) gồm buta–1,3–đien và etan. Rồi sau đó người ta dẫn toàn bộ sản phẩm cháy hấp thụ vào dung dịch H2SO4 đặc. Hỏi khối lượng dung dịch axit tăng thêm bao nhiêu gam ?
A. 3,6 g.
B. 5,4 g.
C. 9,0 g.
D. 10,8 g.
C6. Cho một lượng là 2,24 lít hỗn hợp X gồm buta–1,3–đien và penta–1–3-đien (đktc) có thể tác dụng hết tối đa bao nhiêu lít dung dịch brom 0,10 M ?
A. 2 lít.
B. 1 lít.
C. 1,5 lít.
D. 2,5 lít.
C7: Thí nghiệm trùng hợp đivinyl tạo ra cao su Buna có cấu tạo là ?
A. (-C2H-CH-CH-CH2-)n.
B. (-CH2-CH=CH-CH2-)n.
C. (-CH2-CH-CH=CH2-)n.
D. (-CH2-CH2-CH2-CH2-)n.
C8: Giả sử đốt cháy hoàn toàn hỗn hợp X gồm hai ankađien kế tiếp nhau trong dãy đồng đẳng thì thu được 14,3 gam CO2 và 4,59 gam nước. Vậy 2 ankađien có CT là:
A. C6H10 và C7H12
B. C5H8 và C6H10
C. C4H6 và C5H8
D. C3H4 và C4H6
C9: Biết rằng 1 hỗn hợp X gồm ankađien và H2 có tỷ lệ mol 2 : 3. Nung nóng thu được hỗn hợp Y sau khi cho 0,5 mol hỗn hợp X qua Ni. Cho hỗn hợp Y qua dung dịch brom dư thấy có 0,26 mol Br2 đã phản ứng và thất thoát 4,48 lít hỗn hợp Z với tỉ khối so với H2 là 8. Vậy công thức của ankađien là:
A. C4H6
B. C5H8
C. C3H4
D. C6H10
C10: Giả sử có hỗn hợp X gồm một anken và một ankađien. Tiếp theo người ta cho 3,36 lít hỗn hợp X vào DD brom dư thấy có 32g brom đã phản ứng và khối lượng dung dịch tăng 6,9g. Vậy anken và ankađien có cấu tạo là?
A. C2H4 và C4H6
B. C2H4 và C3H4
C. C3H6 và C4H6
D. C3H6 và C5H8.
Đáp án trắc nghiệm:
1.C
2.A
3.A
4.D
5.B
6.A
7.B
8.C
9.B
10.A
Hy vọng những kiến thức trên đã giúp các bạn hiểu rõ thêm Anken là gì. Cũng như tự tin giải được các bài tập liên quan đến Anken. Chúc các bạn luôn học tập tốt và thành công trong cuộc sống nhé.




























Ý kiến bạn đọc (0)